FDA掀起CAR-T审查风暴,科济药业-B(02171)造血硬伤难阻风险
FDA掀起CAR-T审查风暴,科济药业-B(02171)造血硬伤难阻风险
11月28日,FDA发布公告宣布,FDA生物制剂部门正在对CAR-T细胞疗法可能引发继发性癌症的相关风险展开进一步调查。

智通财经APP观察到,受此“严重风险”风波事件影响,28日美股多家CAR-T概念股股价下跌,其中中概股亘喜生物(GRCL.US)股价跌幅一度达到29.63%。次日,负面消息同样影响了大洋彼岸的港股市场,例如科济药业-B(02171)盘中最大跌幅也超过了20%。
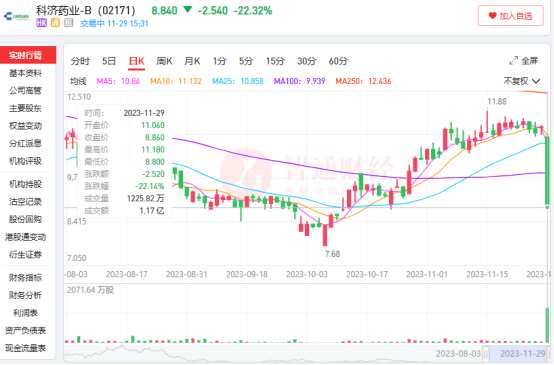
不过并非所有CAR-T研发企业的股价均受到重挫,尤其是那些已实现产品商业化的企业,股价波动并不大。例如,与强生公司合作开发Carvykti的传奇生物(LEGN.US)在消息发布后虽跌至57.38美元低点,但在收盘时仍回升至59.99美元;BMS股价从49.31美元小幅收跌至48.92美元。
也就是说,虽然市场意识到,CAR-T产品在此次风波中存在潜在的“黑框警告”风险,但恐慌情绪基本仅蔓延至那些还未有商业化的标的上,而对于已具备造血能力的企业,市场的态度似乎更为明朗。
潜在的“黑框警告”风险?
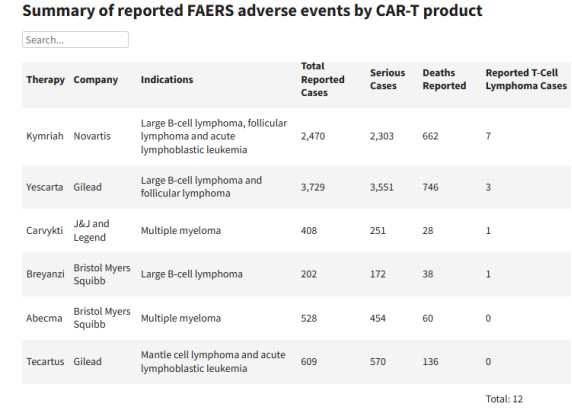
导致此次FDA发布该公告的原因在于,其收到了19例来自临床试验和上市后不良事件(AE)数据源中,BCMA、CD19靶向自体CAR-T细胞免疫疗法治疗的患者出现T细胞恶性肿瘤(一种血癌)的报告,其中一些严重患者已经住院或造成死亡。
并且该公告并非针对某一款产品,而是指出数据库共报告了六款产品的T细胞淋巴瘤病例,包括Breyanzi、Carvykti、Kymriah和Yescarta等。
FDA对CAR-T产品突然“发难”并非偶然。今年6月19日,免疫细胞疗法公司Arcellx宣布收到FDA的通知,要求其暂停用于治疗复发或难治性多发性骨髓瘤患者(rrMM)的CART-ddBCMA疗法的临床,原因是最近一位患者在接受治疗后死亡。
而在11月20日,百时美施贵宝/2seventy bio的CAR-T疗法Abecma,三线治疗多发性骨髓瘤的补充适应症申请遭到FDA推迟。市场推测原因或在于,FDA希望厂商提供更多的总生存期(OS)数据。而不仅仅只提供无进展生存期(PFS)数据。如果这个推测最终被证实,说明FDA对于CAR-T产品的监管正在收紧。
实际上,FDA对CAR-T产品一直有着严格的安全性和有效性审查。通常来说,FDA会要求所有细胞疗法制造商对上市产品进行为期15年的长期研究以监测其安全性。但现在,这则公告意味着FDA未来可能会针对CAR-T产品引发的继发性癌症现象采取更直接的监管行动,例如对已批准产品附加黑框警告内容。
如果FDA是针对所有CAR-T疗法的要求都趋于严格,并让所有产品都面临黑框警告风险,对于CAR-T在研厂商来说,其产品未来的上市进程势必会受到影响。
不过这对那些已经获批上市并成为畅销产品的CAR-T疗法来说,FDA的调查对其现有产品的影响或许并不会特别明显。值得一提的是,针对FDA的审查公告,包括吉利徳、诺华、BMS在内的等多家企业已给出最新积极回应。每家厂商都表示对自家产品的整体安全性“充满信心”,并均补充指出,到目前为止,没有证据表明其产品的治疗与新继发性恶性肿瘤的发生有因果关系。
面对审查,各家公司“悲欢并不相同”
此次各家CAR-T研发企业在二级市场的表现不一,或许侧面反映出投资者对其未来商业化前景的预判。
以此次股价出现暴跌的亘喜生物为例,11月13日美股盘前,亘喜生物公布了其Q3季度财报。数据显示,亘喜生物Q3季度净亏损为6760万元(人民币,下同),较上年同期净亏损1.72亿元实现大幅收窄。而其背后,是亘喜生物研发费用的大幅减少,公司当期研发支出约为9010万元,较上年同期的1.33亿元减少约32.5%。
作为一家成立不过6年的生物技术企业,亘喜生物虽已有产品进入临床阶段,且研发进展迅速,但是至今仍没有产品进入到商业化阶段,因此公司在二级市场还是较难获得认可。
与亘喜生物相同命运的还有此次同样出现暴跌的科济药业。根据科济药业披露的2023年中报,公司为了进一步推进管线内研发进程,公司中期净亏损较上年同期扩大7.5%至4.04亿元。
值得一提的是,两家公司均在研发领域成果颇丰。今年上半年,亘喜生物的GC012F治疗RRMM和r/r B-NHL的研究成果分别入选了2023 ASCO和EHA2023的口头报告;而科济药业GPC3 CAR-T治疗肝细胞癌甚至出现两例逾7年无病生存案例,且这两例长期无病生存案例还在《Cancer Communications》杂志发表并被录用为封面论文。
而对于两家企业出现的研究成果与股价表现的割裂,目前似乎只能用“缺乏造血能力压制估值”来解释。因此此次FDA的监管趋严或许会成为其核心产品未来商业化的“绊脚石”。
但对于传奇生物、吉利德这些已实现产品商业化的企业来说,FDA的所谓黑框警告影响还没到那么大。
因为说到底,黑框警告只是美国 FDA 对上市药物采取的一种对药物使用风险的提醒;附加黑框警告不代表禁用,只是提醒医患更加规范地使用药物;并且黑框警告属于药物安全警戒的常规操作,并不罕见。
据智通财经APP了解,目前全球热门的ADC赛道中,已获批上市的12个ADC分子中10个有黑框警告,占比83.3%;而在近期全球更热门的减肥药赛道中,“神药”司美格鲁肽在临床前期实验中就出现了导致啮齿动物甲状腺C细胞肿瘤发病率增加的情况,正因如此,FDA在该药品说明书上打上了“黑框警告”,以提示甲状腺癌风险。而欧洲药品管理局(EMA)发布了GLP-1类药物的安全信号——具有潜在的甲状腺癌风险。
但对于畅销药来说,“黑框警告”挡不住销量。根据诺和诺德发布的2023Q3财报,其王牌产品司美格鲁肽前三季度销售额总计145.58亿美元,单季度销售额同比大增734%。减肥神药甚至带着“黑框”向K药“药王宝座”发起了总攻。
在CAR-T赛道上,传奇生物与强生合作的Carvykti在今年1-9月合计销售额3.41亿美元,合24.9亿元人民币。目前该产品的季度销售额还在快速增长,今年总销售额也有望突破5亿美元。市场则预计,在保持稳定增速前提下,Carvykti的销售额将在明年突破10亿美元。
加上强生也表示,已经与FDA分享了Carvykti的治疗后监测数据,并正在与FDA合作评估安全信号。以其商业化后往期疗效和销量表现加之与FDA积极配合的态度,此次事件对传奇生物和强生的影响或许并没有那么大,恐慌下跌后又回升的股价也表明了市场的看法。而其背后也在说明,造血能力已成为市场衡量创新药企抗风险能力的重要风向标。
